陶娜等:空心碳纳米酶的温和热疗增强细胞焦亡介导的免疫治疗
发布时间:2023-11-12
点击次数:
免疫检查点阻断(ICB)抗体免疫疗法已经在多种癌症的临床实践中展现出显著益处。然而,肿瘤免疫原性缺陷以及肿瘤微环境中存在的免疫抑制因素限制了肿瘤免疫治疗的效果。焦亡是细胞程序性死亡的一种形式,可释放肿瘤抗原,激活有效的肿瘤免疫原性,并提高ICB治疗效果。然而,目前诱导焦亡以治疗肿瘤的方法仍相对有限。在此,我们提出了一种基于中空碳纳米酶的温和光热增强的焦亡介导的免疫疗法。该方法能够特异性地放大氧化应激引发的焦亡,并同时加强肿瘤微环境中焦亡介导的抗癌反应。具备多种模拟酶活性的铁和铜原子修饰的空心碳球(HCS-FeCu)在光激活下通过自由基ROS-Tom20-Bax-Caspase 3-gasdermin E (GSDME)信号通路诱导细胞焦亡。体外和体内抗 肿瘤结果均证实了HCS-FeCu纳米酶诱导的焦亡的优越性。此外,温和光热刺激联合焦亡可增强抗PD-1治疗对肿瘤免疫系统的作用。理论计算进一步表明,温和光热刺激产生高能电子,增强了HCS-FeCu表面与吸附氧之间相互作用,促进了分子氧的活化,并提高了ROS生成效率。这项工作提出了 一种将“冷”肿瘤有效转化为“热”肿瘤的方法,对临床免疫治疗具有重要意义。

TOC:空心碳纳米酶的温和热疗增强细胞焦亡介导的免疫治疗策略
01 背景介绍
由于ICB在治疗多种恶性肿瘤方面取得了巨大成功,癌症免疫疗法已成为一种重要的癌症治疗策略。然而,对于免疫学“冷”肿瘤的治疗仍然具有挑战性,其特征是缺乏细胞毒性T细胞浸润和无法启动T细胞。焦亡是通过gasdermin(GSDM)介导的裂解性免疫原性细胞死亡过程,在此过程中出现细胞肿胀、裂解和膜孔形成,并释放促发炎因子。作为内源性免疫反应,肿瘤细胞焦亡能够释放细胞内促发炎因子并诱导适应性免疫系统响应,这与ICB联合治疗“冷”肿瘤相协同作用。人们在研究细胞焦 亡相关的免疫治疗方面付出了巨大的努力,包括使用化疗药物顺铂、拓扑替康和米托蒽醌。然而,这些临床应用仍然存在耐药性和明显的毒副作用。
生物体内基础代谢和生命活动的反应动力学与温度密切相关,包括酶反应速率和调节蛋白的速率。目前已经开发出多种基于温和热敏化剂的光热策略。然而,现有光敏化剂仍存在能量转换效率不足之问题。机纳米材料的功能化,可显著提升光热转换效率。中空结构在光参与过程中具有以下优势:
(1) 内腔多次反射光路有利于提高光收集和利用效率;
(2) 较大表面积为反应位点和接触界面提供了足够的数量,并且壳层可以缩短载流子转移路径,从而促进非辐射复合过程以激发电子进行光热转换。在这些中空结构材料中,碳基纳米材料具有明确的电子和几何结构,可调节的催化性能和电光性能。此外,中空碳结构纳米材料不仅在安全辐射能量下表现出温和的高温特性,还可以通过维持氧化应激调节来招募蛋白质以刺激焦亡。
02 工作介绍
近日,中南大学邓留教授、刘又年教授和华中师范大学朱成周教授课题组在ACS Nano上发表题为“A Mild Hyperthermia Hollow Carbon Nanozyme as Pyroptosis Inducer for Boosted Antitumor Immunity”的研究论文。该研究成果成功开发了一种基于空心碳纳米酶的温和热疗增强细胞焦亡介导的免疫治疗策略,该策略能够特异性放大氧化应激引发的细胞焦亡,并同时扩大肿瘤微环境中焦亡介导的抗癌反应。具备多种模拟酶活性的铁和铜原子修饰的空心碳球(HCS-FeCu)在光激活下通过自由基ROS-Tom20-Bax-Caspase 3-gasdermin E (GSDME)信号通路诱导细胞焦亡。理论计算进一步证实,相较于实心碳球,空心碳球表现出更强的光反射能力,从而使其具备更高的光热转换效率。在温和环境下产生的高能量电子通过增强HCS-FeCu表面与吸附氧之间的相互作用来促进分子氧活化,并提升ROS产生效率。ICB的温和光热诱导的细胞焦亡代表了一种有前景的抗肿瘤策略,对临床免疫治疗具有重要意义。
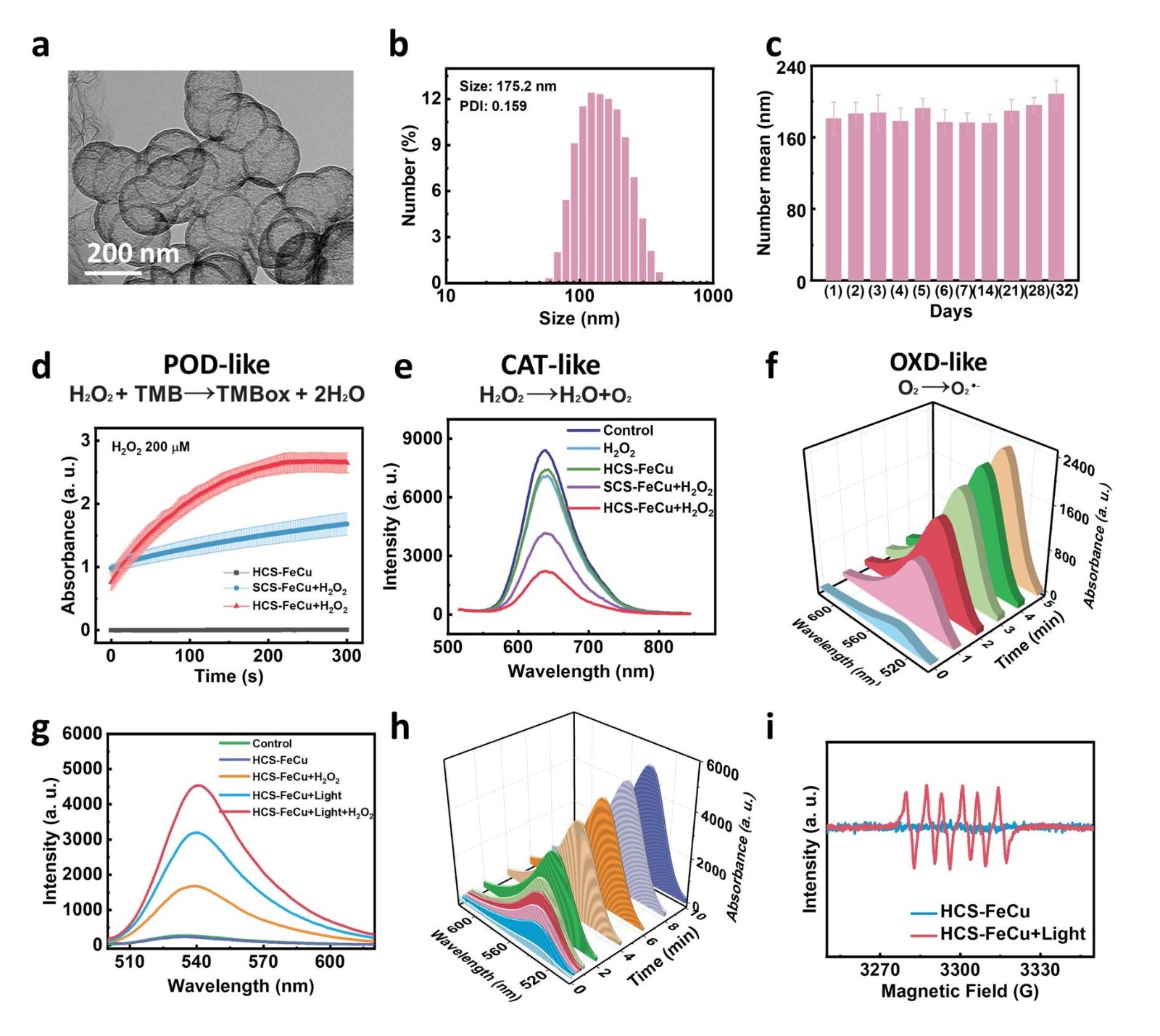
图1. 空心碳纳米酶的表征及多酶模拟活性
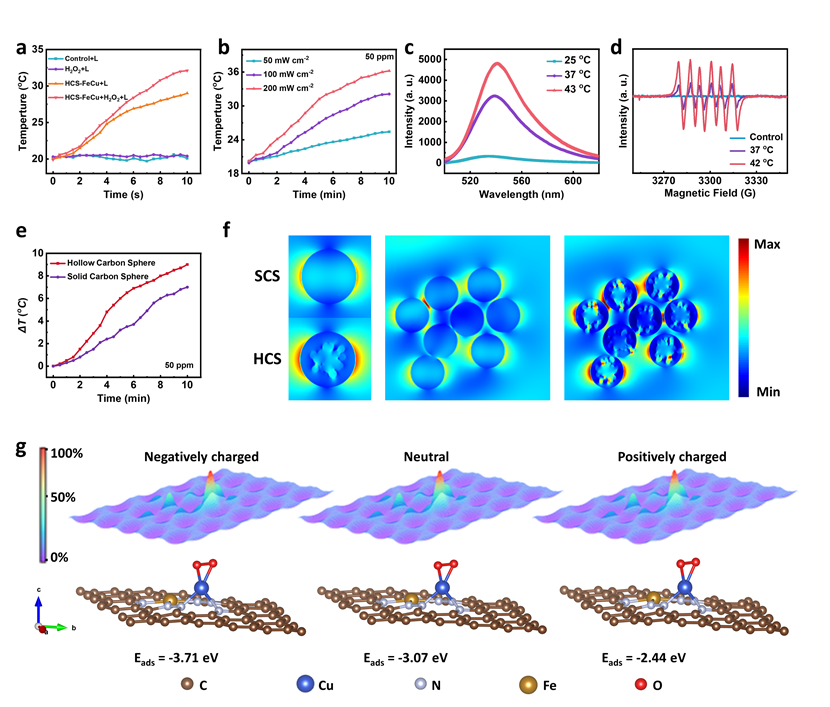
图2. 光照射增强活性氧产生的机制
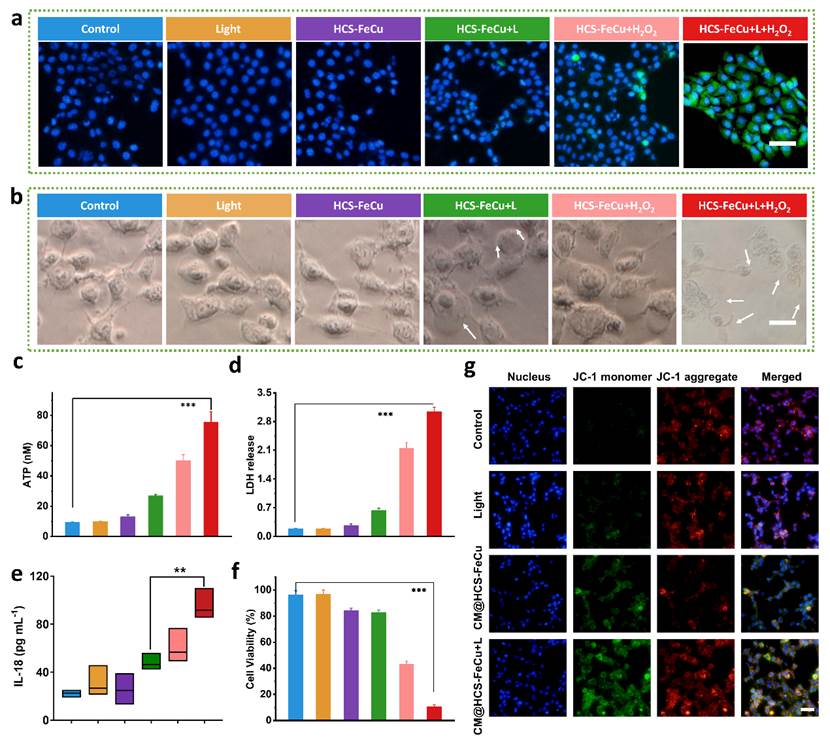
图3. 细胞水平上研究了空心碳纳米酶诱导焦亡的治疗效果
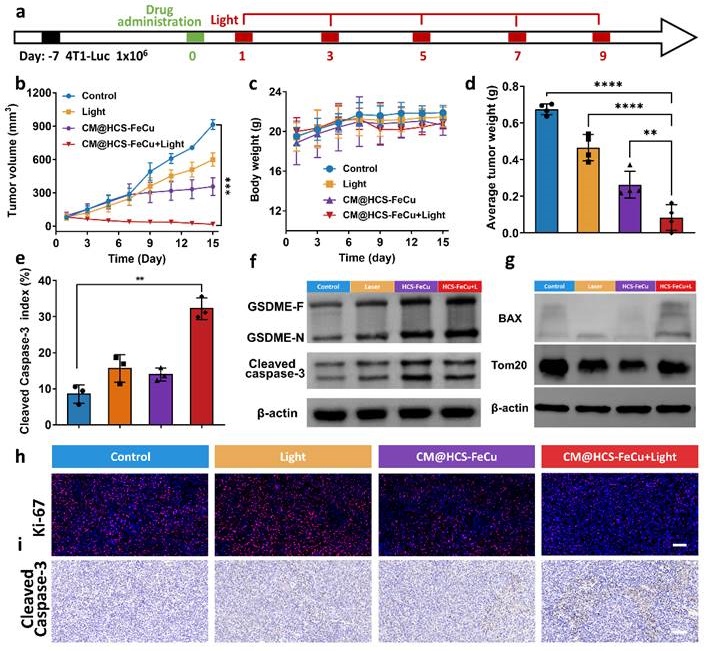
图4. 动物水平上研究了空心碳纳米酶诱导焦亡的治疗效果
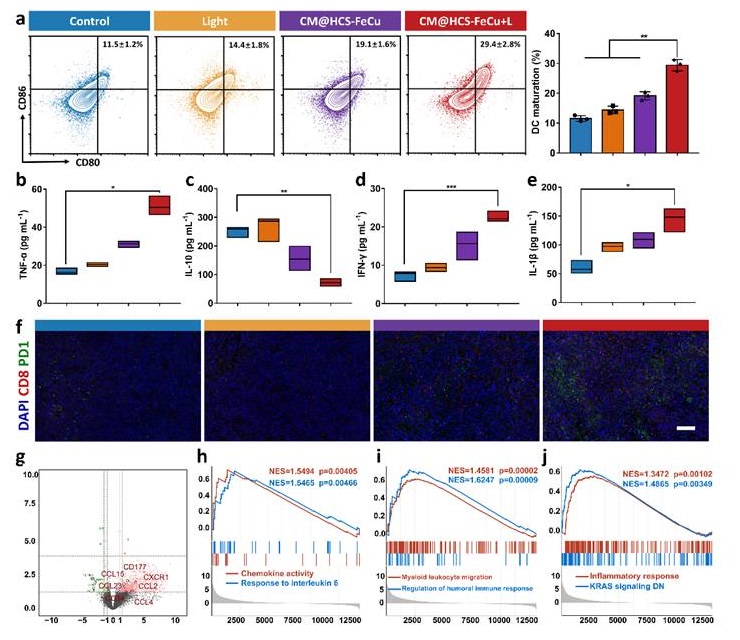
图5. 空心碳纳米酶介导的焦亡增强抗肿瘤免疫反应
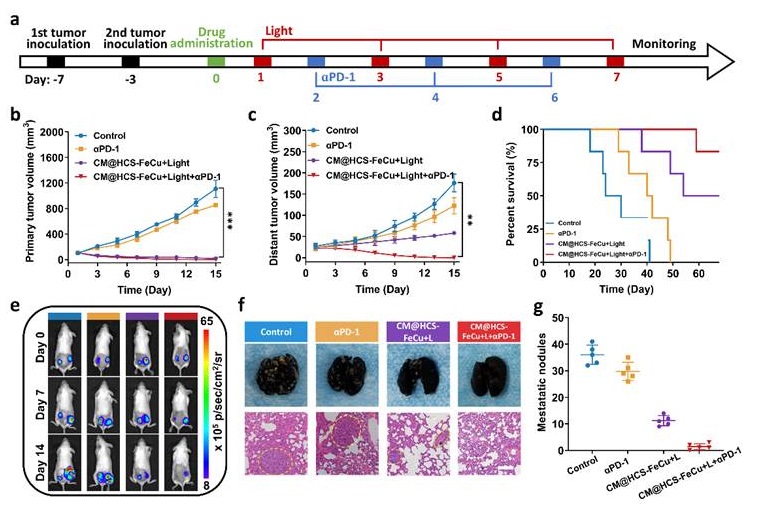
图6. 空心碳纳米酶联合抗PD -1免疫检查点抑制剂治疗,并评估肺抑制转移活性
03 总结与展望
在这项工作中,提出了一种基于纳米酶的温和光热增强策略,以增加ROS的产生,从而诱导细胞焦亡抗肿瘤免疫反应并提高ICB效率。温和光热增强策略表现出对原发性和远处肿瘤的高效抗肿瘤能力,从而解决了缺乏有效诱导细胞焦亡的替代方法的问题。实验研究和理论计算都表明,与实心碳球相比,空心碳球表现出更强的光反射能力,从而导致更高的光热转换效率。在温和环境下光热刺激产生的较高能量电子可以增强HCS-FeCu表面与吸附氧分子之间的相互作用,从而促进氧活化并提高ROS产生效率。此外,产生的ROS可以通过激活ROS-Tom20-Bax-Caspase 3-GSDME依赖性焦亡途径来触发焦亡并刺激抗肿瘤T细胞免疫。温和光热引发的细胞焦亡扩展了抗肿瘤策略,并对临床免疫治疗具有重要意义。
Na Tao, Lei Jiao, Huihuang Li, Liu Deng, Wei Wang, Senfeng Zhao, Wansong Chen, Limiao Chen, Chengzhou Zhu and You-Nian Liu. A mild hyperthermia hollow carbon nanozyme as pyroptosis inducer for boosted antitumor immunity. ACS Nano, 2023, DOI:10.1021/acsnano.3c07601
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c07601
