赵赫楠等:分层纳米结构的人工巨噬细胞用于抗肿瘤免疫仿生重建
发布时间:2023-09-25
点击次数:
内容简介
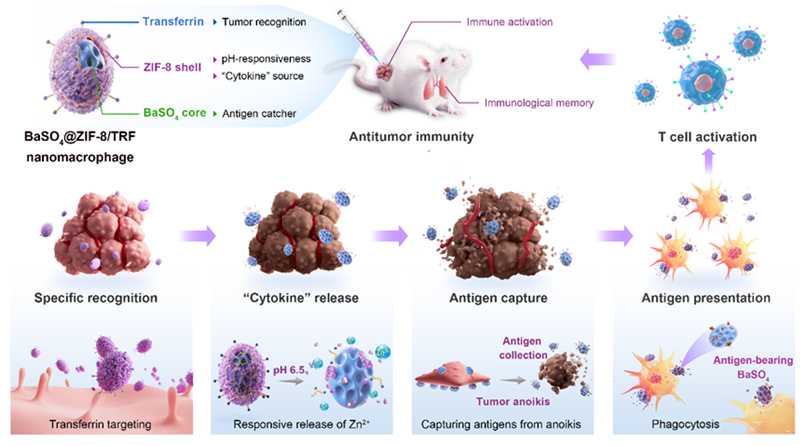
迄今为止,人工巨噬细胞很少被成功制备,这主要由于天然巨噬细胞的生物学功能高度依赖于细胞因子的释放和目标抗原的捕获,两者均为介导抗原呈递和T细胞活化的关键步骤。中南大学刘又年研究团队通过构建具有分层纳米结构的人工巨噬细胞(BaSO4@ZIF-8/TRF NMΦ),成功模拟了包括肿瘤滞留、细胞因子释放、抗原捕获等天然免疫活性巨噬细胞的基本功能,触发高效的抗肿瘤免疫反应。人工巨噬细胞(NMΦ)通过转铁蛋白(TRF)对肿瘤细胞的特异性亲和力稳定滞留在肿瘤部位,在酸性微环境中释放Zn2+作为“人工细胞因子”,诱导肿瘤失巢凋亡,释放大量肿瘤抗原,增强免疫原性,逆转肿瘤免疫抑制。此外,释放的肿瘤抗原可以被BaSO4纳米颗粒的空腔选择性捕获,有效地促进巨噬细胞M1极化、树突细胞成熟和T细胞活化。BaSO4@ZIF-8/TRF纳米人工巨噬细胞成功激活了全身抗肿瘤免疫并建立免疫记忆,抑制肿瘤转移与复发,有望为人工细胞的设计和生物医学应用提供示例。
图1. (a) BaSO4@ZIF-8/TRF NMΦ的制备流程图;(b) BaSO4和(c) BaSO4@ZIF-8纳米颗粒的TEM和元素映射图像;(d) BaSO4@ZIF-8纳米颗粒的XPS光谱;(e) (1) BaSO4、(2) ZIF-8、(3) BaSO4@ZIF-8 (pH=7.4)及(4) BaSO4@ZIF-8 (pH=6.5)的XRD谱图;(f) TRF、BaSO4@ZIF-8纳米粒子和BaSO4@ZIF-8/TRF NMΦs的紫外吸收光谱;(g) BaSO4@ZIF-8/TRF NMΦs中Ba2+和Zn2+的pH响应释放曲线。
II 人工细胞因子诱导肿瘤失巢凋亡
巨噬细胞的免疫应答高度依赖于细胞因子的分泌来调节肿瘤细胞的死亡和免疫细胞的活化。为了确定Zn2+作为人工促炎细胞因子的抗肿瘤作用及其相关机制,本实验验证了NMΦs 的肿瘤杀伤活性及死亡方式。BaSO4@ZIF-8/TRF纳米人工巨噬细胞作用4T1肿瘤细胞后,胞内Zn2+含量远高于其他正常细胞系,导致超过70%的肿瘤细胞被杀死。BaSO4@ZIF-8/TRF NMΦs诱导的肿瘤细胞死亡是通过Zn2+的释放,激活JNK和BAK/BAX通路,进而诱发线粒体功能障碍、细胞周期阻滞、细胞骨架坍塌等,启动细胞失巢凋亡进程,而这些细胞死亡进程均能够通过Zn2+螯合剂被抑制(图2)。
图2. (a) BaSO4@ZIF-8/TRF和BaSO4@ZIF-8/TRF+CQ与 4T1、3T3和L02细胞共孵育不同时间后,胞内Zn2+含量;(b) 不同浓度BaSO4@ZIF-8/TRF NMΦs对正常和肿瘤细胞的细胞毒性;(c)不同纳米药物处理后肿瘤细胞骨架的荧光图像;(d)肿瘤细胞在不同药物处理后的免疫印迹分析;(e) BaSO4@ZIF-8/TRF NMΦs诱导肿瘤细胞失巢凋亡的机理图;(f)不同药物处理后肿瘤细胞的细胞周期分布。组别:(1) control; (2) BaSO4; (3) ZIF-8/TRF; (4) BaSO4@ZIF-8; (5) BaSO4@ZIF-8/TRF; (6) BaSO4@ZIF-8/TRF+CQ.。
III 人工巨噬细胞抗原捕获能力评估
除了细胞因子分泌外,抗原捕获是巨噬细胞的另一个显著特征。BaSO4@ZIF-8/TRF纳米人工巨噬细胞通过诱导肿瘤细胞的免疫原性死亡,暴露大量相关抗原。其ZIF-8壳在肿瘤酸性微环境分解后,核心的BaSO4纳米颗粒暴露出平均直径约为20 nm的空腔,由于Ba和Ca具有相同的膜蛋白结合位点,允许Ba代替Ca位点通过范德华作用和库仑力结合膜蛋白,因而BaSO4纳米颗粒与富Ca膜蛋白的结合效率远高于其他蛋白,被BaSO4纳米颗粒选择性捕获(图3)。
图3. (a)不同药物处理后肿瘤细胞ATP释放量;(b)共聚焦显微镜图像显示不同药物处理后4T1肿瘤细胞CRT的膜富集和HMGB1的易位;(c) pH=6.5时BaSO4@ZIF-8/TRF的TEM和元素映射图。(d)不同药物处理后4T1细胞和L02细胞的SEM伪彩色图像;(e)不同纳米颗粒在不同pH条件下与BSA、细胞膜蛋白和TRF的结合能力;(f) 50 ns内不同蛋白在BaSO4基底上的MD模拟、(g)库仑相互作用能和范德华能。组别:(1) control; (2) BaSO4; (3) ZIF-8/TRF; (4) BaSO4@ZIF-8; (5) BaSO4@ZIF-8/TRF。
IV 人工巨噬细胞体内外免疫评估
通过体外Transwell侵袭实验结果显示,BaSO4@ZIF-8/TRF NMΦs作为一种人工巨噬细胞,其捕获的抗原能够被80%以上的抗原提呈细胞识别摄取,促进炎性细胞因子TNF-α和IL-6的释放,降低抑炎因子IL-10的分泌,具备良好的体外免疫应答效应。此外,为了评估BaSO4@ZIF-8/TRF NMΦs在体内调节免疫细胞的能力,通过向小鼠瘤内注射人工巨噬细胞来模拟天然巨噬细胞的空间分布。肿瘤微环境中的BaSO4@ZIF-8/TRF NMΦs不仅诱导周围巨噬细胞的M1型极化,还能够进一步促进树突细胞成熟、细胞毒性T淋巴细胞和辅助T细胞的活化,成功逆转肿瘤免疫抑制,激活全身抗肿瘤免疫(图4)。
图4. (a) BaSO4@ZIF-8/TRF NMΦs体外抗原捕获的transwell模型示意图;(b)共聚焦荧光图像定位巨噬细胞中肿瘤抗原和纳米颗粒;(c)流式细胞术分析不同药物处理后的M1和M2巨噬细胞群; (d) TNF-α、(e) IL-6和(f) IL-10在不同药物处理后的分泌情况;(g)体内不同药物处理后DC成熟、(h)辅助T细胞和(i)细胞毒性T细胞分化情况。组别:(1) control; (2) BaSO4; (3) ZIF-8/TRF; (4) BaSO4@ZIF-8; (5) BaSO4@ZIF-8/TRF。
V 体内抗肿瘤免疫疗效
为了评估BaSO4@ZIF-8/TRF NMΦs的体内抗肿瘤免疫效果,本实验构建了双侧4T1荷瘤小鼠模型。在治疗过程中结合PD-1抗体作为典型的免疫检查点阻断剂,通过BaSO4@ZIF-8/TRF NMΦs诱导的肿瘤失巢凋亡,原发肿瘤抑制率可达到95%。此外,细胞毒性T细胞和辅助T细胞能够迁移到远处肿瘤进行免疫攻击,从而抑制远端肿瘤生长约90%,将小鼠存活率大幅提高至83%(图5)。
图5. (a)不同药物处理后原发肿瘤组织E-钙粘蛋白和(b)整合素β1的免疫荧光染色图像;(c) Western blotting分析不同药物处理后肿瘤组织中失巢凋亡相关蛋白的表达;(d)不同组4T1-Luc荷瘤小鼠的代表性生物发光图像;(e)不同组小鼠原发肿瘤和(f)远处肿瘤生长曲线;(g) 各组小鼠的生存曲线。组别:(1) control, (2) BaSO4, (3) αPD-1, (4) ZIF-8/TRF, (5) BaSO4@ZIF-8, (6) BaSO4@ZIF-8/TRF, (7) ZIF-8/TRF+αPD-1, (8) BaSO4@ZIF-8/TRF+αPD-1。
VI 免疫记忆的建立
为了评估BaSO4@ZIF-8/TRF 纳米人工巨噬细胞的免疫记忆效应,荷瘤小鼠在经过治疗后被肿瘤细胞重新刺激。未经治疗的荷瘤小鼠75%以上的肺表面分布着大量转移结节,而BaSO4@ZIF-8/TRF 纳米人工巨噬细胞结合anti-PD-1治疗可以完全抑制肿瘤肺部转移。这主要是由于BaSO4@ZIF-8/TRF NMΦs诱导抗肿瘤适应性免疫,肿瘤的复刺激激活了效应记忆T细胞对肿瘤抗原的免疫记忆,提供了长期的肿瘤防治效果(图6)。
图6. (a)体内免疫记忆效应研究流程表;(b)不同药物治疗后肺转移的体内生物发光图像及(c)数码照片;(d) H&E染色检查肺转移;(e)肺转移结节的统计结果;(f)脾淋巴细胞效应记忆T细胞流式细胞术数据及(g)统计结果;(h)各组小鼠血液生化分析。组别:(1) control, (2) BaSO4, (3) αPD-1, (4) ZIF-8/TRF, (5) BaSO4@ZIF-8, (6) BaSO4@ZIF-8/TRF, (7) ZIF-8/TRF+αPD-1, (8) BaSO4@ZIF-8/TRF+αPD-1。
附件: